![Интернет-кружок по химии, 8 класс, примеры [Интернет-кружок по химии, 8 класс, примеры]](/img/theme/subjects/chemistry-64.png) | Интернет-кружок по химии, 8 класс, примерыИнтернет-кружок по химии, 8 класс, примеры |
Примерные серии задач интернет-кружка
Примерные серии задач интернет-кружка
1 серия (сентябрь) учебного года 2025-2026
Химия - наука о веществах и их превращениях
Окружающие нас предметы - это физические тела.
То, из чего состоит физическое тело, называется вещество.

На приведенном рисунке мы видим деревянную линейку.
Линейка - физическое тело. Вещество, из которого сделана линейка, древесина. Линейка может быть сделана из других веществ: металла, пластмассы.
Тела можно пересчитать (одна линейка, две линейки ...). Тела характеризуются размерами - длиной, высотой, шириной.
Вещества характеризуются агрегатным состоянием (жидкие, твердые, газообразные), растворимостью в воде и других растворителях, температурой плавления, температурой кипения, плотностью.
Когда мы говорим: "тяжёлый портфель", то это означает, что портфель имеет большую массу. А если мы говорим: "тяжёлый газ", то это означает, что газ имеет большую плотность.
Частицы, из которых состоят вещества, называются молекулами. Не все вещества состоят из молекул, они могут состоять и из других частиц, с которыми мы познакомимся позже.
Молекула - минимальная частица вещества, сохраняющая его химические свойства.
Молекулы состоят из атомов.
Определенный вид атомов называется химическим элементом.
На сегодняшний день известно $\displaystyle 118$ химических элементов.
Все химические элементы расположены определенным образом в Периодической системе химических элементов Д. И. Менделеева.
Каждый элемент имеет свой порядковый номер, своё русское и латинское название, свой символ. Символы химических элементов содержат одну или две буквы латинского алфавита. Первая буква всегда заглавная, вторая - строчная.
Названия и химические символы некоторых элементов
|
Название элемента |
Символ |
Произношение |
|
|
Русское |
Латинское |
символа |
|
|
Серебро |
Argentum |
Ag |
аргентум |
|
Алюминий |
Aluminium |
Al |
алюминий |
|
Углерод |
Carboneum |
C |
це |
|
Кальций |
Calcium |
Ca |
кальций |
|
Хлор |
Clorum |
Cl |
хлор |
|
Медь |
Cuprum |
Cu |
купрум |
|
Железо |
Ferrum |
Fe |
феррум |
|
Водород |
Hydrogenium |
H |
аш |
|
Калий |
Kalium |
K |
калий |
|
Магний |
Magnesium |
Mg |
магний |
|
Азот |
Nitrogenium |
N |
эн |
|
Кислород |
Oxigenium |
O |
о |
|
Фосфор |
Phoshorus |
P |
пэ |
|
Сера |
Sulfur |
S |
эс |
|
Цинк |
Zinkum |
Zn |
цинк |
|
Кремний |
Silicium |
Si |
силициум |
Для изображения качественного и количественного состава вещества используются химические формулы. Качественный состав показывает, атомы каких элементов входят в состав молекулы. (Так как не все вещества имеют молекулярное строение, иногда говорят не о составе молекулы, а о составе формульной единицы вещества). Количественный состав показывает, сколько атомов этих элементов входит в состав молекулы (формульной единицы).
Число атомов элемента в молекуле обозначается числом, стоящим за символом этого элемента в формуле, и называется индексом. Если число атомов элемента в молекуле равно одному, то цифра $\displaystyle 1$ не указывается. Например, формула молекуды воды $\displaystyle H_2O$ показывает, что в состав молекулы воды входит два атома водорода и один атом кислорода.
Индекс, стоящий после скобок, относится ко всем элементам, символы которых находятся в скобках. Например, $\displaystyle Cu(OH)_2$ - в состав формульной единицы этого вещества входит один атом меди, два атома кислорода и два атома водорода.
Вещества, состоящие из атомов одного элемента, называются простыми, например, $\displaystyle Fe,\, H_2,\, O_3$.
Названия простых веществ чаще всего, но не всегда, совпадают с названиями элементов: $\displaystyle H_2$ - водород.
Одному химическому элементу может соответствовать несколько простых веществ: $\displaystyle O_2$ - кислород, $\displaystyle O_3$ - озон. Такое явление называется аллотропия. Кислород и озон - аллотропные модификации кислорода.
Вещества, состоящие из атомов нескольких элементов, называются сложными, например: $\displaystyle FeCl_3,\, H_2O,\, Na_2CO_3$.
Необходимо различать, когда в высказываниях идет речь о простом веществе, а когда об атомах элемента, входящих в состав сложного вещества. Например, в предложении " Рыбы дышат растворенным в воде кислородом" речь идет о простом веществе - кислороде $\displaystyle O_2$. А в предложении "В состав воды входит кислород" речь идет об атомах элемента кислород, входящих в состав молекул воды $\displaystyle H_2O$.
Чистое вещество состоит из частиц только одного вещества, смесь веществ состоит из частиц разных веществ.
Дистиллированная (перегнанная) вода состоит только из молекул воды - это чистое вещество. Если же в воду добавить сахар, то мы получим смесь веществ. Медь - чистое вещество, а бронза - смесь веществ. Бронза представляет собой сплав меди с оловом.
Задание 1:
Укажите, является данное понятие веществом или телом
мел
капля воды
серебро
Задание 2:
Укажите сложное вещество
Варианты ответов:
Задание 3:
Вспомнив латинские и русские названия элементов, определите, какое из указанных веществ называется нитрид кальция.
Варианты ответов:
Задание 4:
Выберите высказывание, в котором говорится о железе как простом веществе.
Варианты ответов:
Задание 5:
Расположите приведенные вещества в порядке увеличения числа атомов водорода в одной формульной единице. В ответе запишите номера веществ в соответствующем порядке.
1. $\displaystyle Ca(HCO_3)_2$
2. $\displaystyle (NH_4)_2HPO_4$
3. $\displaystyle NaHSO_4$
4. $\displaystyle Fe(OH)_3$
5. $\displaystyle (NH_4)_2SO_4$
Задание 6:
Смесью веществ является
Варианты ответов:
Задание 7:
При $\displaystyle 0^oC$ и давлении, равном $\displaystyle 1$ атм, плотность воздуха составляет $\displaystyle 1{,}295$ г/л. Вычислите массу (в граммах) $\displaystyle 22{,}4$ литров воздуха в этих условиях. В ответе запишите число с точностью до целых
38 серия (май) учебного года 2025-2026
Лабораторное оборудование
В химических чаще всего лабораториях используют следующую посуду и оборудование.
Пробирки простые и калиброванные (с делениями, указывающими объем) для проведения опытов с небольшим количеством реактивов. Объем реактива в пробирке не должен превышать половины ее объема.

Лабораторные стаканы различных размеров, с носиком и без носика. Стаканы предназначены для выполнения самых разнообразных процедур.
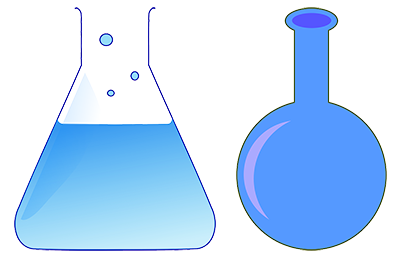
Колбы различного размера и формы (круглые, конические, плоскодонные, круглодонные).
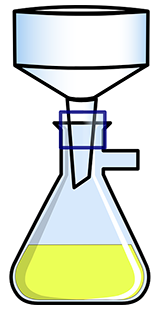
Воронки химические служат для переливания жидкостей и фильтрования;

капельные воронки используют для введения в реакционную среду жидких реактивов небольшими порциями;

воронки делительные применяют для разделения несмешивающихся жидкостей.
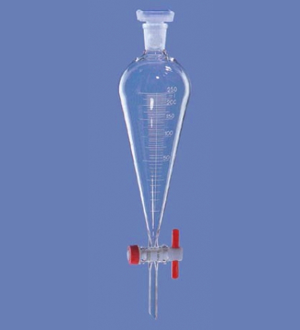
Аппарат Киппа – прибор для получения водорода, сероводорода, оксида углерода (IV) и других газов в лаборатории.

Мерные колбы служат для приготовления растворов точной концентрации.

Мерные цилиндры служат для измерения объема жидкости.

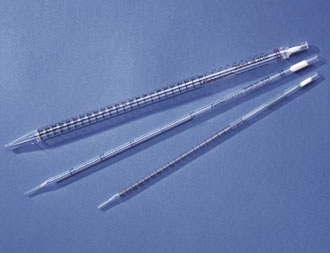
Пипетки служат для отбора точно определенных относительно небольших объемов жидкостей.
Бюретки служат для отмеривания точных объемов жидкостей, преимущественно при химико-аналитических работах (титрование).

Штативы с набором муфт, лапок и колец используют для закрепления на них во время работы различных приборов, стеклянной посуды (холодильников, колб, делительных воронок и пр.).

Держатели для пробирок – приспособления, которые используются при непродолжительном нагревании пробирок.

Спиртовки - нагревательные приборы для непродолжительного нагревания небольшого количества вещества.

Ступка с пестиком используется для измельчения твердых веществ.

Основные приёмы работы в химической лаборатории
Нагревание: нагревать можно только небольшие количества веществ (не более $\displaystyle 1/3$ объёма пробирки). В начале прогревают всю пробирку, а затем место, где находится содержимое. Нагревание проводят только в термостойкой посуде.
Упаривание: проводится на водяной или песчаной бане.
Определение запаха: при определении запаха, выделяющегося при реакции, нужно движениями ладони направить струю газа от отверстия реакционного сосуда к себе и осторожно вдохнуть.
Работа со спиртовкой:
- этиловый спирт заливают в резервуар не более половины его объёма, спиртовку зажигают с помощью спички или горящей лучины;
- запрещается перемещать горящую спиртовку;
- гасить горящую спиртовку можно только с помощью колпачка.
При обращении с веществами и оборудованием необходимо соблюдать правила техники безопасности:
- во время работы на лабораторном столе не должны находиться посторонние предметы;
- в лаборатории необходимо работать в специальном халате, при необходимости использовать защитные очки и резиновые перчатки;
- запрещается принимать пищу в лаборатории;
- все опыты с ядовитыми и сильно пахнущими веществами проводятся в вытяжном шкафу;
- химические реактивы можно брать только индивидуальным шпателем или пинцетом;
- неизрасходованные вещества нельзя высыпать обратно в те сосуды, из которых они были взяты; излишки подвергаются утилизации;
- работы с едкими веществами (щёлочи, кислоты) необходимо выполнять в резиновых перчатках и защитных очках;
- сосуд с нагреваемой жидкостью нельзя закрывать пробкой; при нагревании пробирки следует использовать пробиркодержатель; нельзя наклоняться над сосудом, в котором происходит нагревание жидкости, отверстие нагреваемой пробирки должно быть отвёрнуто от работающего;
- при разбавлении концентрированных кислот необходимо кислоту приливать к воде небольшими порциями при постоянном перемешивании;
- при попадании кислоты на кожу необходимо промыть место ожога проточной водой в течении нескольких минут, а затем обработать $\displaystyle 3\%$-ным раствором питьевой соды. При ожоге концентрированными растворами щелочей обожжённое место промывают проточной водой $\displaystyle 2-3$ мин., а затем обрабатывают $\displaystyle 1\%$-ным раствором уксусной кислоты и затем снова промывают водой;
- легковоспламеняющиеся жидкости и твёрдые вещества необходимо держать вдали от огня;- при термическом ожоге необходимо охладить поражённое место под струёй проточной холодной воды и наложить стерильную повязку;
- при попадании реактива в глаз необходимо промыть глаз проточной водой и обратиться к врачу.
Виды смесей и способы их разделения
Чистыми называют вещества, не содержащие примесей других веществ. Они обладают постоянными физическими свойствами.
Смесями называются системы, состоящие из двух и более веществ. Физические свойства смесей не постоянны. Свойства каждого из веществ, составляющих смесь сохраняются.
Неоднородными называются смеси, в которых невооружённым глазом или при помощи микроскопа можно разглядеть частицы, составляющие смесь.
Однородными называются смеси, в которых даже вооружённым глазом невозможно разглядеть частицы, составляющие смесь. К однородным смесям относятся, например, истинные растворы.
Смеси веществ встречаются гораздо чаще, чем абсолютно чистые вещества. В природе индивидуальные вещества практически не встречаются. Поэтому для исследования свойств и применения веществ необходимо выделять их из смеси.
Для разделения смесей используются различные методы, основанные на отличии физических свойств веществ, образующих смесь (плотность, растворимость, температура кипения, способность намагничиваться и т. д.):
I. Способы разделения однородных смесей.
1) выпаривание и кристаллизация - для выделения нелетучих твёрдых веществ из растворов.
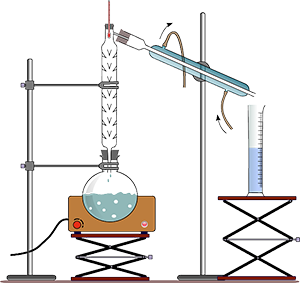
2) дистилляция (перегонка) - для разделения смесей, образованных жидкостями с различными температурами кипения.
II. Способы разделения неоднородных смесей:
1) отстаивание - для разделения смеси твёрдого нерастворимого вещества и жидкости или двух не смешивающихся жидкостей разной плотности. Например, смесь песка и воды или смесь растительного масла и воды. Для разделения жидкостей используют делительную воронку. Для ускорения отстаивания можно использовать центрифугирование - разделение компонентов смеси под действием центробежной силы.
2) фильтрование - процесс отделения твёрдых веществ от жидкости или газа при помощи пористого материала (фильтра), пропускающего частицы жидкости или газа, но задерживающего твёрдые частицы.
3) намагничивание - для разделения смесей, в состав которых входят намагничиваемые металлы и сплавы (железо, сталь, чугун).
Способы собирания газов
Газы можно собирать двумя способами – методом вытеснения воды и методом вытеснения воздуха.
Методом вытеснения воды можно собирать только те газы, которые не растворяются в воде и не реагируют с водой (кислород, водород, метан и др.).
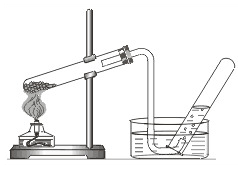
Аммиак и хлороводород нельзя собирать методом вытеснения воды, т.к. они очень хорошо растворяются в воде.
Метод вытеснения воздуха используют для собирания как растворимых (аммиак, углекислый газ), так и нерастворимых в воде газов.
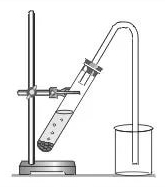
При собирании газов легче воздуха сосуд для сбора газа следует закрепить дном вверх:
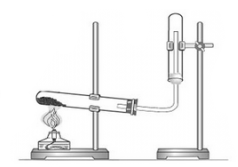
А для газов, которые тяжелее воздуха, – дном вниз:
Задание 1:
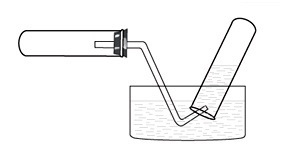
В приборе, изображенном на рисунке, можно собирать каждый из двух газов
Варианты ответов:
Задание 2:
Очистить бензин от попавшей в него воды можно с помощью
Варианты ответов:
Задание 3:
Отобрать из раствора пробу объёмом $\displaystyle 10$ мл можно с помощью
Варианты ответов:
Задание 4:
Газ, выделившийся при прокаливании $\displaystyle 1{,}58$ г перманганата калия, собрали методом вытеснения воды в мерный цилиндр. Объём газа оказался равным $\displaystyle 84$ мл. Определите выход (в процентах от теоретического) газообразного продукта реакции.
Задание 5:
Растворы солей бария ядовиты, из нельзя сливать в канализацию. Утилизацию отходов растворов солей бария можно проводить в условиях школьной лаборатории.
Отработанные растворы солей бария собирают в отдельные сосуды и обрабатывают избытком раствора сульфата калия или натрия, затем отфильтровывают твёрдый осадок сульфата бария и выбрасывают с твёрдыми отходами в мусорный контейнер.
Вычислите массу $\displaystyle 10\%$-ного раствора сульфата натрия, которым можно полностью осадить ионы бария из $\displaystyle 520$ г $\displaystyle 20\%$-ного раствора хлорида бария, подлежащего утилизации.
Задание 6:
Укажите, являются приведенные высказывания верными или неверными.
При нагревании колбы с легкокипящей жидкостью колбу следует плотно закрыть пробкой
При приготовлении раствора кислоты кислоту льют в воду
Получать хлор можно только в вытяжном шкафу
Задание 7:
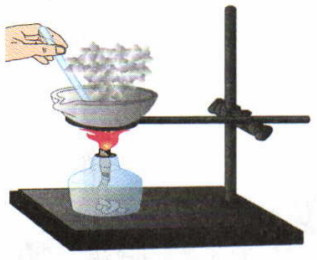
На пронумерованных рисунках изображены некоторые процессы, проводимые при разделении смесей. Выберите рисунки, изображающие действия, которые Вы будете производить при очистке поваренной соли от примеси речного песка. Расположите их в нужной последовательности. В ответе запишите номера выбранных рисунков в соответствующей последовательности.
1) 
2) 
3) 
4) 
Как записаться в кружок?
- Зарегистрироваться в МетаШколе
- Войти в МетаШколу со своим логином и паролем
- Перейти по ссылке "Все кружки"
- Добавить кружок в корзину.
- Перейти на страницу "Корзина", выбрать способ оплаты, оплатить.
![[Математический кружок]](/img/logo/header-ru-transparent-v5.png)